吡咯是一种重要的五元芳香杂环结构,吡咯及其衍生物是最重要的五元含氮杂环骨架材料和关键结构核,在药物化学、材料科学和天然产物等领域有着广泛的应用。
传统的制备方法通过羰基化合物与胺的缩合反应得到吡咯分子,如Knorr吡咯合成、Hantzsch吡咯合成,Barton–Zard吡咯合成反应和Paal-Knorr反应,该类合成方法往往需要在高温、强酸、强碱等条件进行,因而限制了部分含敏感基团试剂的使用。对于有机化学、药物化学和材料科学来说,多取代吡咯的进一步研究仍然是非常重要和迫切需要的。
近期有一些过渡金属催化的环化反应被开发出来,此类条件具有较好区域选择性和条件温和的特点。

【J. Am. Chem. Soc. 2020, 142, 22, 9908–9914】
一、Hantzsch吡咯合成法
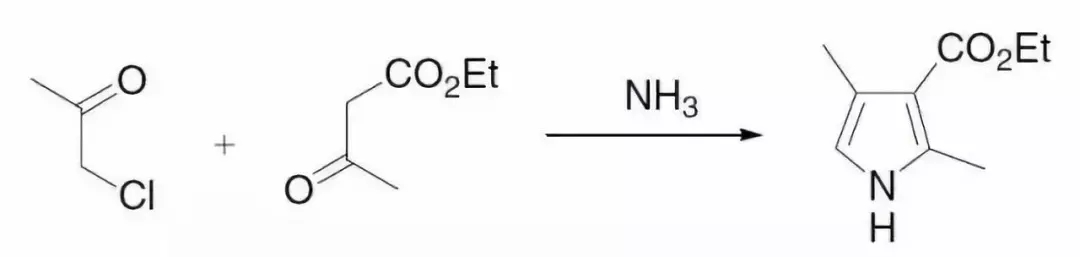
α-卤代甲基酮,β-酮基酯和氨缩合得到吡咯的反应。
二、Paal–Knorr吡咯合成

1,4-二酮和伯胺(或氨)反应制备吡咯的反应。此反应是Knorr吡唑合成的变体。
三、Knorr吡咯合成

α-氨基酮和α位有吸电子基团的羰基化合缩合得到吡咯的反应。
该反应由德国化学家路德维希·诺尔(Ludwig Knorr)首先报道。一般地,氨基酮应做成盐酸盐,或原位生成中间体后立即参加反应(如以氨基肟作原料),以防止氨基酮发生自身缩合。
反应机理:首先是酮和胺缩合形成亚胺,通过互变异构转化成烯胺的形式,随后环化,脱水,异构化即得到吡咯。

四、TosMIC和烯烃反应(Van Leusen 吡咯合成 ),常用试剂-对甲苯磺酰甲基异氰

五、Barton–Zard吡咯合成反应
通过硝基烯烃与α-异腈酸酯之间的所和反应得到吡咯环衍生物的手法。

六、Piloty-Robinson Pyrrole Synthesis

肼和两倍当量的醛做原料,合成3,4位上具有特定取代基的吡咯。反应生成二亚胺中间体(R–C=N−N=C–R),然后在盐酸作用下重排,失去一分子氨关环得取代吡咯。
七、Zavyalov吡咯合成反应
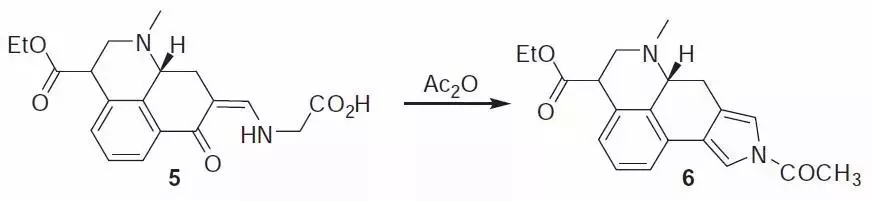
烯胺酮(或1,3-二羰基化合物)和α-甘氨酸在乙酸酐中反应得到N-乙酰基吡咯的反应。
八、Clauson-Kaas吡咯合成反应

2,5-二烷氧基四氢呋喃和伯胺反应制备N-取代吡咯的反应。此反应是一种保护伯胺的方法。此方法得到的吡咯,官能团耐受度高,可以进行各种高活性的反应。
九、Hinsberg吡咯合成反应
类似Hinsberg噻吩合成反应,二(2-乙酸酯基)胺和草酸二甲基在碱性条件下缩合得到吡咯。

十、其他

先进行1,3-偶极环加成反应(1,3-Dipolar Cycloaddition),再进行逆-DA反应。

类似Click反应叠氮-炔环加成。
十一、钯催化吡咯合成

【Chem. Commun., 2000, 873-874】

【J. Am. Chem. Soc., 2011, 740-743】
【化学空间】Narasaka-Heck环化反应
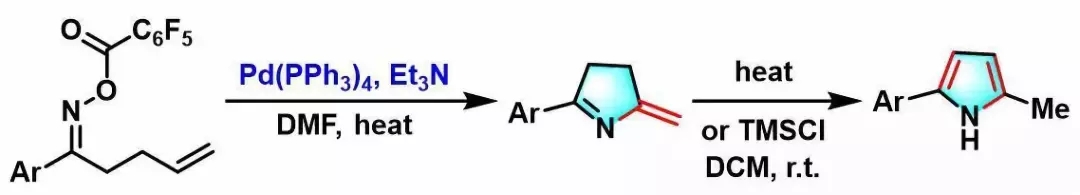
1999年,日本东京大学化学系 (東京大学理学部化学教室,Department of Chemistry, Tokyo University)的奈良坂纮一 (奈良坂 紘一,Narasaka Koichi)研究室报道了钯催化剂参与的γ, δ-不饱和酮肟酯 (γ, δ-unsaturated oxime esters,其中γ, δ-不饱和酮-O-五氟苯甲酰氧基肟最为常用)的氮杂Heck-Mizoroki环化 (aza-Heck-Mizoroki cyclization,又称为amino-Heck reaction),形成吡咯环的反应[1],该反应称为Narasaka-Heck环化反应 (Narasaka-Heck cyclization)。
十二、铜催化

【J. Org. Chem. 2018, 83, 2104−2113】

【Green Chem., 2018, 20, 4409-4413】

此方法底物普适性很高。对于芳基取代的烯炔,该反应体系产率最高可达到88%。烷基取代的烯炔,该催化体系同样适应性良好。产率最高可达到72%。
【J. Am. Chem. Soc. 2020, 142, 22, 9908–9914】
十三、过渡金属催化的环异构化反应

铜催化的N-烷氧基环丙酮亚胺的环异构化合成吡咯。方法区域选择性的合成不同取代基的吡咯,包括完全取代的吡咯。该方法成功地应用于甾体吡咯的合成,以及N-稠合吡咯的合成。
关键词:吡咯 合成反应
分享至:
![]()
![]()




鄂公网安备 42011102004299号
© 2014-2024 前衍化学科技(武汉)有限公司 版权所有 鄂ICP备20009754号-1